LA VERA RIVOLUZIONE DELLA TELEMATICA:
La Collaborazione Clinica
Negli ultimi 20 anni abbiamo fatto del dialogo tra pari (peer to peer) una missione imprenditoriale ed oggi più che mai la collaborazione clinica è da considerarsi un elemento indispensabile per far fronte alle difficili sfide derivanti dall’invecchiamento della popolazione, dall’inquinamento e dai flussi migratori. Oggi fare collaborazione clinica tra soggetti che, pur operando nella stessa organizzazione sanitaria, utilizzano strumenti digitali diversi è difficile se non impossibile. Senza strumenti adeguati che possano aiutare i medici a condividere le informazioni cliniche che provengono dalle più disparate fonti aumenta esponenzialmente il rischio clinico nonché lo spreco di risorse finanziarie strutturalmente scarse a fronte di bisogni di salute potenzialmente infiniti.
le nuove opportunità da cogliere
Tech2Doc: L’intervento di Giorgio Moretti
Giorgio Moretti, Chairman di Dedalus Group, affronta il tema di come gli strumenti di telemedicina possano diventare un asset di reale beneficio dei medici per curare al meglio i pazienti, in un video di approfondimento sulle “Infrastrutture digitali a beneficio dei clinici: le nuove opportunità da cogliere”, disponibile su Tech2Doc, la piattaforma dì empowerment formativo/informativo dei medici e odontoiatri sui temi della Digital Health, creata e promossa dalla Fondazione ENPAM.
Di seguito un breve estratto del Video, all’interno del quale, partendo dall’analisi del dibattito culturale-contenutistico italiano in materia di telemedicina, Moretti approfondisce i tecnicismi propri della pratica e della sua regolamentazione passando dalle dinamiche di attuazione alle casistiche estere (con un particolare occhio di riguardo per le case history tedesche e inglesi). Infine, enfatizza il ruolo chiave della condivisione di informazioni cliniche nei processi decisionali in ambito sanitario.
Guarda il video completo su Tech2Doc.it
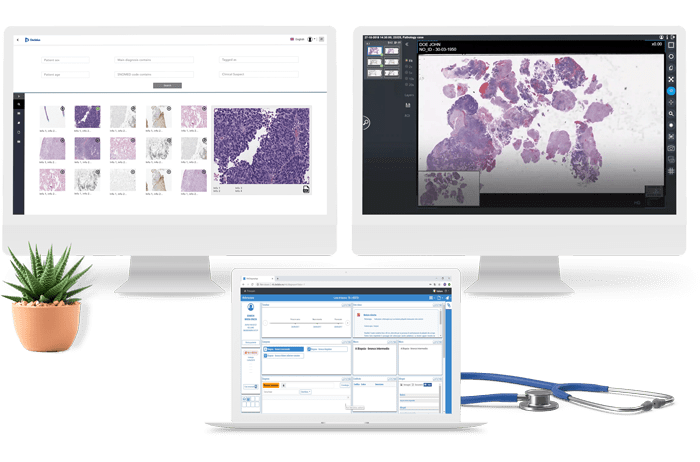
Qualità clinica e controllo del rischio
Il Portale Clinico della Conoscenza
Stiamo perfezionando uno spazio comune in cui i clinici possano definire attraverso un approccio “social” i casi di maggiore interesse clinico e sufficientemente standardizzabili da creare uno standard comune di analisi e condivisione (di immagini, dati, esiti) e quindi di definizione delle azioni da intraprendere a partire dalle buone pratiche individuate dal confronto tra pari. Non resta che aprire “tecnicamente” questo spazio a software esistenti, per consentire a queste definizioni di diventare contenuti operazionali per l’utilizzo nella pratica clinica quotidiana. Una possibile soluzione potrebbe sembrare quella di fornire lo stesso strumento di cartella clinica elettronica – EMR a tutti i clinici coinvolti, chiedendo loro di utilizzare un unico approccio di codifica: nel nostro mondo questo non è realistico né realizzabile. I medici, legittimamente, non vogliono cambiare il loro EMR attuale o cambiare il modo in cui codificano le informazioni cliniche; i costi di questo tipo di progetto (diretti e per la gestione del cambiamento) sarebbero davvero troppo elevati. Un valore speciale del CKP emerge inoltre nella gestione degli studi clinici. Oggi i Clinical Trials sono un processo molto complesso. La difficoltà degli EMR di raccogliere informazioni cliniche uniformi obbliga i medici che fanno ricerca a dover inserire in elementari software dedicati, le informazioni cliniche del paziente, costringendoli ad una duplicazione nell’inserimento dei dati, con un elevato rischio di errori e complessivamente una qualità del dato bassa.
Grazie al CKP diviene possibile utilizzare direttamente i dati clinici “caldi”, ovvero quelli raccolti e gestiti per la cura del paziente, anche per lo scopo secondario della ricerca, semplificando enormemente il processo, aumentando la qualità complessiva dei dati raccolti e garantendo l’assoluto rispetto delle normative GDPR in materia di consenso all’utilizzo dei dati.
Scopri di più: www.clinicalknowledgeportal.com

Usabilità, ergonomia, completezza
4C – Una suite allo stato dell’arte per operare in tutti i contesti clinici
Le cartelle cliniche elettroniche nascono per permettere di creare e condividere informazioni sintetiche, chiare e leggibili. Oggi, dopo 40 anni di accesi dibattiti con i clinici, è chiaro che questo non può che avvenire partendo dallo user journey, operando in totale sicurezza e riducendo al minimo il tempo trascorso davanti al monitor. La nostra Suite clinica si rinnova costantemente con l’evolversi della pratica clinica e si basa su tre concetti fondanti: la Collaborazione Clinica, la Personalizzazione delle Cure e la Prossimità dell’Assistenza. Dati questi presupposti, la Suite 4C (certificata Dispositivo Medico di Classe II.B) permette al Team Clinico di operare in totale sicurezza, riducendo drasticamente il rischio del caso clinico e ottimizzandone le tempistiche. Non solo, la Suite 4C permette di lavorare fruendo di Linee Guida interattive ed in totale trasparenza su Dati interoperabili, quindi condivisibili e monitorabili nel tempo a beneficio della continuità delle cure e di tutto il Team Clinico multi-specialistico. Il valore aggiunto di uno strumento così disegnato è dato inoltre dalla possibilità di definire di volta in volta le informazioni chiave per quel caso clinico, ovvero per studi clinici strutturati, perché il Dato non rimanga tale ma diventi vera ed utile Informazione.
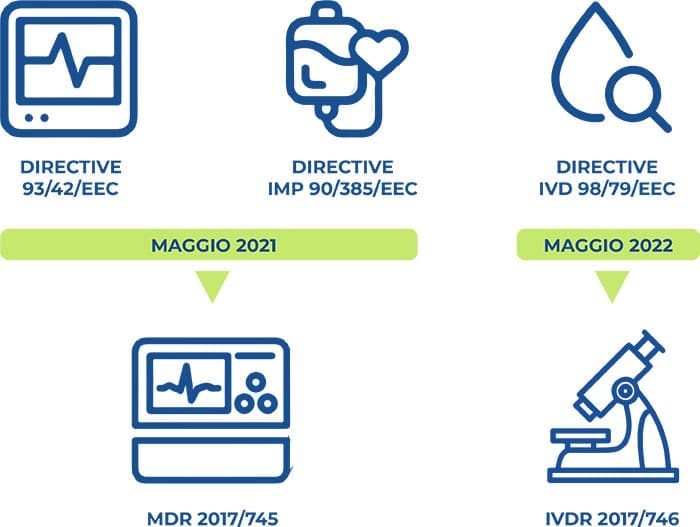
Non più software ma strumenti certificati
Il nuovo Regolamento Europeo sui Dispositivi Medici Software
Nel maggio 2017 è entrato in vigore il Regolamento Europeo sui Dispositivi Medici – DM (EU MDR – The European Union Medical Device Regulation), approvato dal Consiglio Europeo e dal Parlamento Europeo all’inizio di quell’anno, ponendo le basi per la sua applicazione. Inizialmente fissata al 26 maggio 2020, nell’aprile 2020 la DoA (Date of Application) della MDR è stata posticipata di un anno in risposta alla pandemia di COVID-19. Il regolamento è stato introdotto per affrontare una serie di punti deboli delle normative esistenti, ossia le Direttive sui DM (MDD – Medical Device Directive). Il nuovo regolamento sui DM, ivi compreso il Dispositivo Medico Software (MDSW), garantirà senza alcun dubbio una maggiore sicurezza ed efficacia, ma anche un’aumentata trasparenza grazie alla divulgazione di informazioni pubbliche sui DM e alla loro registrazione all’EUDAMED (European Database on Medical Devices), la nuova Banca Dati Europea dei Dispositivi Medici.
La parola “Sicurezza” appare 290 volte nell’MDR. L’MDD, in confronto, lo usa solo 40 volte.
I dispositivi medici non marcati CE sono sempre soggetti a sequestro amministrativo poiché, ai sensi della Legge n.689/81, il sequestro è disposto nei casi in cui è ammessa la confisca e tale misura è obbligatoria per le cose la cui alienazione costituisce violazione amministrativa.
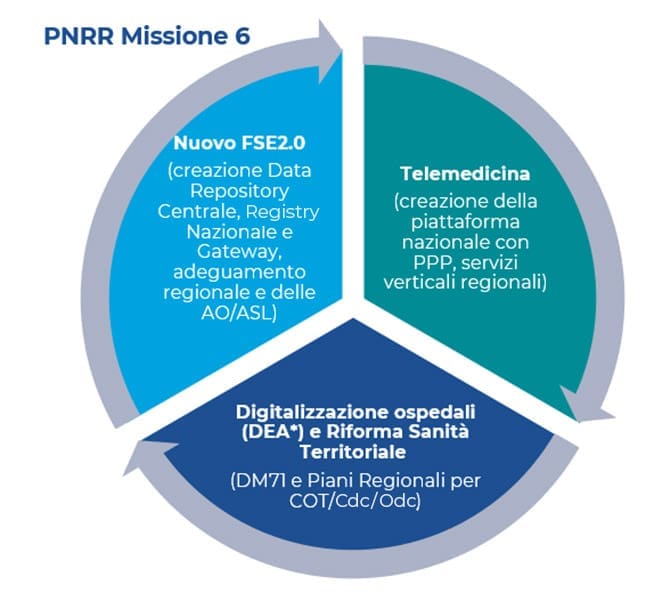
Un’occasione irripetibile per evolvere il sistema
PNRR e digitalizzazione del SSN
La Missione 6 del PNRR contiene tutti gli interventi a titolarità del Ministero della Salute suddivisi in due componenti. È stata assegnata ad Agenas, quale tramite per il Ministero della Salute, l’attuazione degli interventi relativi alla Missione 6 Salute componente C1 (M6C1: Reti di Prossimità, Strutture e Telemedicina per l’Assistenza Sanitaria Territoriale). La seconda componente invece riguarda l’area R&D che pure spinge con altrettanta forza verso la digitalizzazione (M6C2: Innovazione, Ricerca e Digitalizzazione del Servizio Sanitario Nazionale). Il Decreto del Ministero dell’Economia e Finanze, 6 agosto 2021, assegna alle singole amministrazioni le risorse finanziare per l’attuazione degli interventi di cui sono titolari. A partire da gennaio 2022 tutti i soggetti attuatori (Regioni e/o altri Enti o Aziende Territoriali da esse nominati) del PNRR sono chiamati a individuare, programmare e realizzare gli investimenti, previsti dal Recovery Plan, che li coinvolgono. In particolare, è in atto il percorso che sta portando le Regioni a sviluppare i contenuti dei CIS (Contratti istituzionali di Sviluppo), individuando le opere e i progetti da realizzare sul territorio (con schede di progetto) e l’Action Plan (e relative Milestones). In Dedalus sono attivi alcuni momenti formativi e di confronto sia sui contenuti del PNRR sia sui diversi modelli di procurement attivabili


